

 [羅戈導(dǎo)讀]FDA-GMP六大系統(tǒng)講解學(xué)習(xí)
[羅戈導(dǎo)讀]FDA-GMP六大系統(tǒng)講解學(xué)習(xí)
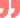
六大系統(tǒng):質(zhì)量系統(tǒng)、設(shè)施與設(shè)備系統(tǒng)、物料系統(tǒng)、生產(chǎn)系統(tǒng)、包裝與標(biāo)簽系統(tǒng)、實(shí)驗(yàn)室控制系統(tǒng)。
1、質(zhì)量系統(tǒng)
質(zhì)量系統(tǒng)的評(píng)估有兩個(gè)階段。第一階段為評(píng)價(jià)該質(zhì)量部門是否履行了審查和批準(zhǔn)與生產(chǎn)、質(zhì)量控制和質(zhì)量保證相關(guān)的所有程序,并且確保這些程序適宜于其預(yù)期用途的職責(zé)。這亦包括相關(guān)的記錄保管系統(tǒng)。第二階段為評(píng)估收集來(lái)鑒定質(zhì)量問(wèn)題的資料并且可以連接到用于檢查范圍的其它主要系統(tǒng)。
對(duì)于每個(gè)下述通報(bào)項(xiàng)目,該廠商應(yīng)該備有書(shū)面和批準(zhǔn)的程序以及援引的文件證明。一有可能,應(yīng)該通過(guò)監(jiān)察,驗(yàn)證該廠商對(duì)于書(shū)面程序的遵守。這些范圍不限于原料藥成品,也可能包括起始原料和中間體。這些范圍不僅可能顯示在該系統(tǒng)內(nèi)的缺陷,而且可能顯示在會(huì)確保范圍擴(kuò)展的其它系統(tǒng)內(nèi)的缺陷。該系統(tǒng)下所有范圍都應(yīng)該被覆蓋;但是覆蓋的實(shí)際深度可以因計(jì)劃的檢查策略而異,取決于檢查所發(fā)現(xiàn)的情況。
● 確保履行質(zhì)量部門職責(zé)的員工的適應(yīng)性。
● 如ICH Q7A§2.5《產(chǎn)品質(zhì)量考察》所述定期質(zhì)量考察;檢查審計(jì)范圍應(yīng)該包括在該場(chǎng)所生產(chǎn)的代表性原料藥類型;檢查審計(jì)也應(yīng)該檢查某一批和與每項(xiàng)原料藥質(zhì)量考察有關(guān)的資料記錄,以驗(yàn)證該廠商的評(píng)論充分完整;以及審計(jì)應(yīng)該確認(rèn)廠商已經(jīng)鑒定任何動(dòng)向以及已經(jīng)糾正或者清除不能接受的變化的起因。
●(質(zhì)量和醫(yī)學(xué)方面的)投訴評(píng)價(jià):以一種及時(shí)的方式用文件證明、評(píng)價(jià)、調(diào)研;包括糾正舉措(如果適宜)。確定投訴的方式以及原料藥批的內(nèi)部退回或者再加工/返工的記錄是否保證檢查的擴(kuò)展。
●與生產(chǎn)和測(cè)試有關(guān)的偏差和失誤調(diào)研:用文件證明、評(píng)價(jià)、以一種及時(shí)的方式調(diào)研的關(guān)鍵偏差以及擴(kuò)展到包括任何有關(guān)的原料藥和原料;包括糾正舉措(如果適宜)。
● 變化控制(包括“工藝改進(jìn)”:用文件證明、評(píng)價(jià)、批準(zhǔn)、評(píng)估的重新驗(yàn)證的需要)。
●返回/回收:評(píng)估、被保證處擴(kuò)展的調(diào)研、最終處置。
● 退回:被保證處擴(kuò)展的調(diào)研、糾正舉措(如果適宜)。
● 發(fā)放原料的系統(tǒng)。
●從最后一次檢查以來(lái)生產(chǎn)的幾批,以評(píng)價(jià)起因于加工問(wèn)題的任何退回或者轉(zhuǎn)換(即從藥用到非藥用)。
● 妥善審定再加工和/或返工事件和評(píng)價(jià)對(duì)于原料質(zhì)量的影響。
●召回(包括任何試圖回收已經(jīng)分銷的、不符合其規(guī)格或者所聲稱的質(zhì)量的原料藥),確定原因以及采取的糾正舉措。
● 穩(wěn)定性不合格:被保證處擴(kuò)展的調(diào)研、處置。確定穩(wěn)定性資料是否支持原料藥復(fù)測(cè)或者失效期以及儲(chǔ)存條件。
● 驗(yàn)證:驗(yàn)證/重新驗(yàn)證工作的情況(例如,計(jì)算機(jī)、生產(chǎn)過(guò)程、分析方法),例如驗(yàn)證方案和報(bào)告的評(píng)論和批準(zhǔn)。
● 質(zhì)量控制部門職能員工的培訓(xùn)/資格確認(rèn)。
對(duì)于質(zhì)量系統(tǒng)的ICH Q7A參考文獻(xiàn):
● §2,質(zhì)量管理
● §13,變化控制
● §14,原料的退回和再利用
●§15,投訴和召回
●§16,合同生產(chǎn)(包括分析)。
2、設(shè)施和設(shè)備系統(tǒng)
對(duì)于下述各項(xiàng),該廠商應(yīng)該備有書(shū)面程序和批準(zhǔn)程序以及援引的文件證明。一有可能,應(yīng)該通過(guò)監(jiān)察來(lái)驗(yàn)證廠商對(duì)于書(shū)面程序的遵守。這些范圍不僅可能顯示在該系統(tǒng)內(nèi)的缺陷,而且可能顯示在會(huì)確保范圍擴(kuò)展的其它系統(tǒng)內(nèi)的缺陷。除了質(zhì)量系統(tǒng)以外,在為了覆蓋而選擇本系統(tǒng)時(shí),應(yīng)該覆蓋下文列舉的所有區(qū)域;但是,覆蓋的實(shí)際深度可以因計(jì)劃的檢查策略而異,取決于檢查所發(fā)現(xiàn)的情況。
1. 設(shè)施
●清潔和維修。
●為了防止交叉污染的設(shè)施配置、材料流向和人員流向,包括來(lái)自于非藥品材料的加工。
● 特定區(qū)域或者高敏材料(例如,青霉素、β-內(nèi)酰胺類、甾類化合物、激素和細(xì)胞毒素)的密閉度控制。
● 諸如蒸汽、氣體、壓縮空氣、加熱、通風(fēng)和空調(diào)的輔助設(shè)備應(yīng)該符合要求并且妥善監(jiān)控(注:該系統(tǒng)僅包括其輸出不會(huì)整合入原料藥的輔助設(shè)備,例如用于冷卻/加熱夾套容器的水)。
● 照明、下水道系統(tǒng)和廢物處置、洗滌和衛(wèi)生設(shè)施。
● 用于建筑物內(nèi)實(shí)施變化的控制系統(tǒng)。
● 建筑物的衛(wèi)生,包括采用殺鼠藥、殺真菌劑、殺蟲(chóng)劑、清潔劑和衛(wèi)生洗滌劑。
l 員工的培訓(xùn)和資格確認(rèn)。
2.工藝設(shè)備
●設(shè)備安裝、操作、性能鑒定(如果適宜)。
● 妥善的設(shè)計(jì)、適宜的規(guī)格和對(duì)于其預(yù)期用途的合適定位。
● 設(shè)備表面應(yīng)該沒(méi)有會(huì)在(生產(chǎn))過(guò)程中改變物料質(zhì)量的反應(yīng)性、添加性(additive)或者吸收性。
●設(shè)備(例如反應(yīng)器、儲(chǔ)藏容器)和永久安裝的工藝管道應(yīng)該妥善鑒定。
●與設(shè)備運(yùn)行有關(guān)的物質(zhì)(例如潤(rùn)滑劑、加熱流體或者冷卻劑)不應(yīng)該接觸起始原料、中間體、原料藥成品和容器。
● 清潔程序和清潔驗(yàn)證以及衛(wèi)生處理研究應(yīng)該被評(píng)價(jià),以驗(yàn)證殘余物、微生物和內(nèi)毒素污染(如果適宜)被清除到醫(yī)學(xué)限度以下。
● 采用起源于法定標(biāo)準(zhǔn)(以美國(guó)國(guó)家標(biāo)準(zhǔn)技術(shù)研究所(NIST,The National Institute of Standards and Technology,“米國(guó)國(guó)立標(biāo)準(zhǔn)技術(shù)研究所”)、美國(guó)藥典(USP)或者對(duì)方承認(rèn)的確定標(biāo)準(zhǔn)的國(guó)家政府權(quán)威機(jī)構(gòu)為佳)的標(biāo)準(zhǔn)進(jìn)行校準(zhǔn)。
● 設(shè)備合格證明、校準(zhǔn)和維修,包括采用計(jì)算機(jī)進(jìn)行合格證明/驗(yàn)證和保障。
● 用于實(shí)施設(shè)備變化的控制系統(tǒng)。
● 任何偏差的文件證明(質(zhì)量系統(tǒng)所覆蓋的關(guān)鍵偏差的調(diào)研)。
● 員工的培訓(xùn)和資格確認(rèn)。
對(duì)于設(shè)施和設(shè)備系統(tǒng)的ICH Q7A參考文獻(xiàn):
● §4,建筑物和設(shè)施
● §5,工藝設(shè)備
● §6,文件證明和記錄
3、物料系統(tǒng)
對(duì)于下述各項(xiàng),該廠商應(yīng)該備有書(shū)面程序和批準(zhǔn)程序以及援引的文件證明。一有可能,應(yīng)該通過(guò)監(jiān)察來(lái)驗(yàn)證廠商對(duì)于書(shū)面程序的遵守。這些范圍不限于原料藥成品,也可能包括起始原料和中間體。這些范圍不僅可能顯示在該系統(tǒng)內(nèi)的缺陷,而且可能顯示在會(huì)確保范圍擴(kuò)展的其它系統(tǒng)內(nèi)的缺陷。除了質(zhì)量系統(tǒng)以外,在為了覆蓋而選擇本系統(tǒng)時(shí),應(yīng)該覆蓋下文列舉的所有區(qū)域;但是,覆蓋的實(shí)際深度可以因計(jì)劃的檢查策略而異,取決于檢查所發(fā)現(xiàn)的情況。
● 員工的培訓(xùn)和資格確認(rèn)。
● 起始原料和容器的鑒定。
● 儲(chǔ)藏條件。
● 所有物料和原料藥的儲(chǔ)備,包括在被隔離狀態(tài)下后處理過(guò)的物料,直至被測(cè)試或者檢驗(yàn)和發(fā)放。
● 采用合適的手段和對(duì)照合適的質(zhì)量規(guī)格,采集、測(cè)試或者檢驗(yàn)代表性樣品。
●評(píng)價(jià)關(guān)鍵物料供應(yīng)商的系統(tǒng)。
● 不符合驗(yàn)收標(biāo)準(zhǔn)的任何起始原料、中間體或容器的退回。
● 起始原料、中間體或容器的妥善再測(cè)試/再檢驗(yàn)。
● 按照“先進(jìn)/先出”原則,物料和容器的使用。
● 被退回物料的隔離和及時(shí)處置。
● 用于生產(chǎn)原料藥的生產(chǎn)用水的適應(yīng)性,包括水系統(tǒng)設(shè)計(jì)、維修、驗(yàn)證和運(yùn)行(如果適宜)。
● 用于生產(chǎn)原料藥的工藝過(guò)程的氣體(例如用來(lái)沖洗反應(yīng)器的氣體)的適應(yīng)性,包括氣體系統(tǒng)設(shè)計(jì)、維修、驗(yàn)證和運(yùn)行(如果適宜)。
● 容器和密封應(yīng)該沒(méi)有反應(yīng)性、添加性(additive)或者吸收性。
● 用于實(shí)施變化的控制系統(tǒng)。
● 計(jì)算機(jī)化過(guò)程或者自動(dòng)化過(guò)程的認(rèn)證/驗(yàn)證和保障。
● 每批原料藥成品的分銷記錄。
● 任何偏差的文件證明(在質(zhì)量系統(tǒng)下的關(guān)鍵偏差調(diào)研)。
對(duì)于物料系統(tǒng)的ICH Q7A參考文獻(xiàn):
● §7,物料管理
● §10,儲(chǔ)藏和分銷
● §4.3,水
● §6,文件證明和記錄
4、生產(chǎn)系統(tǒng)
對(duì)于下述各項(xiàng),該廠商應(yīng)該備有書(shū)面程序和批準(zhǔn)程序以及援引的文件證明。一有可能,應(yīng)該通過(guò)監(jiān)察來(lái)驗(yàn)證廠商對(duì)于書(shū)面程序的遵守。這些范圍不限于原料藥成品,也可能包括起始原料和中間體。這些范圍不僅可能顯示在該系統(tǒng)內(nèi)的缺陷,而且可能顯示在會(huì)確保范圍擴(kuò)展的其它系統(tǒng)內(nèi)的缺陷。除了質(zhì)量系統(tǒng)以外,在為了覆蓋而選擇本系統(tǒng)時(shí),應(yīng)該覆蓋下文列舉的所有區(qū)域;但是,覆蓋的實(shí)際深度可以因計(jì)劃的檢查策略而異,取決于檢查所發(fā)現(xiàn)的情況。
● 員工的培訓(xùn)/資格確認(rèn)。
● 被批準(zhǔn)的生產(chǎn)程序的確定、遵守和文件證明的實(shí)績(jī)。
● 用于實(shí)施工藝變化的控制系統(tǒng)。
● 對(duì)于關(guān)鍵工作和操作的控制。
●關(guān)鍵性偏差的文件證明和調(diào)研。
● 選定的工藝步驟的實(shí)際收率與期望收率的比較。
● 用于完成生產(chǎn)階段的妥善確定的時(shí)間限度。
● 用于生產(chǎn)中間體和原料藥的主要設(shè)備的妥善鑒定。
● 中間體規(guī)格和原料藥規(guī)格的合理性和一致性。
● 工藝控制、測(cè)試和檢驗(yàn)(例如pH、溫度、純度、實(shí)際收率、澄清度)的實(shí)施和文件證明。
● 應(yīng)該使用旨在防止被取樣物料污染的程序,進(jìn)行過(guò)程中取樣。
● 反應(yīng)物的回收(例如從母液或者濾液);批準(zhǔn)的程序和回收的物料符合適宜于其預(yù)期用途的規(guī)格。
● 如果在重復(fù)使用或者摻合以前溶劑符合相應(yīng)的標(biāo)準(zhǔn),可以用同樣的工藝或者不同的工藝回收和重復(fù)使用溶劑。
● 在多用途設(shè)備上原料藥超微粉碎(micronization)以及廠商采取預(yù)防措施,以防止或者最小化交叉污染的潛勢(shì)。
● 工藝驗(yàn)證,包括計(jì)算機(jī)化過(guò)程或者自動(dòng)化過(guò)程的驗(yàn)證和保障。
●母料(master batch)生產(chǎn)和控制記錄。
● 批生產(chǎn)和控制記錄。
● 任何偏差的文件證明(在質(zhì)量系統(tǒng)下的關(guān)鍵偏差調(diào)研)。
對(duì)于生產(chǎn)系統(tǒng)的ICH Q7A參考文獻(xiàn):
● §6,文件證明和記錄
● §8,生產(chǎn)和過(guò)程中控制
● §12,驗(yàn)證
● §18,由細(xì)胞培養(yǎng)/發(fā)酵生產(chǎn)的原料藥的特殊控制
至于有關(guān)發(fā)酵工藝、提取工藝和精制工藝的附加檢驗(yàn)指導(dǎo),同時(shí)參見(jiàn)7356.0002M。
5、包裝和標(biāo)簽系統(tǒng)
對(duì)于下述各項(xiàng),該廠商應(yīng)該備有書(shū)面程序和批準(zhǔn)程序以及援引的文件證明。一有可能,應(yīng)該通過(guò)監(jiān)察來(lái)驗(yàn)證廠商對(duì)于書(shū)面程序的遵守。這些范圍不限于原料藥成品,也可能包括起始原料和中間體。這些范圍不僅可能顯示在該系統(tǒng)內(nèi)的缺陷,而且可能顯示在會(huì)確保范圍擴(kuò)展的其它系統(tǒng)內(nèi)的缺陷。除了質(zhì)量系統(tǒng)以外,在為了覆蓋而選擇本系統(tǒng)時(shí),應(yīng)該覆蓋下文列舉的所有區(qū)域;但是,覆蓋的實(shí)際深度可以因計(jì)劃的檢查策略而異,取決于檢查所發(fā)現(xiàn)的情況。但是,涉及的實(shí)際深度可以因計(jì)劃的檢查策略而異,取決于檢查發(fā)現(xiàn)。
● 員工的培訓(xùn)和資格確認(rèn)。
● 包裝材料和標(biāo)簽材料的驗(yàn)收操作。
● 用于實(shí)施包裝操作和標(biāo)簽操作的變更的控制系統(tǒng)。
● 經(jīng)過(guò)批準(zhǔn)的和發(fā)放后返回的標(biāo)簽和貼標(biāo)簽(labeling)的妥善儲(chǔ)藏。
● 用于不同原料藥而尺寸、形狀和色彩類似的標(biāo)簽的控制。
● 妥善的包裝記錄(包括所有用過(guò)的標(biāo)簽的樣張)。
● 標(biāo)簽發(fā)放的控制、發(fā)出的標(biāo)簽的檢查和用過(guò)的標(biāo)簽的核對(duì)。
● 粘貼標(biāo)簽的原料藥成品的檢查。
● 入庫(kù)標(biāo)簽的妥善檢驗(yàn)(驗(yàn)證)。
● 批號(hào)的使用、產(chǎn)生過(guò)度標(biāo)記的批號(hào)/控制編號(hào)的破壞(destruction)。
● 一次標(biāo)識(shí)多個(gè)批號(hào)時(shí),妥善隔離和控制。
● 標(biāo)簽上妥善的失效期或者復(fù)測(cè)期。
● 包裝操作和標(biāo)簽操作的驗(yàn)證,包括計(jì)算機(jī)化過(guò)程的驗(yàn)證和保障。
● 任何偏差的文件證明(在質(zhì)量系統(tǒng)下的關(guān)鍵偏差調(diào)研)。
對(duì)于包裝和標(biāo)簽系統(tǒng)的ICH Q7A參考文獻(xiàn):
● §9,原料藥和中間體的包裝和識(shí)別性標(biāo)簽
● §17,代理商、中介商、貿(mào)易商、分銷商、重新包裝商和重新標(biāo)簽商(適宜于在生產(chǎn)原地以后和在制劑生產(chǎn)商接受以前原料藥的處置)
6、實(shí)驗(yàn)室控制系統(tǒng)
對(duì)于下述各項(xiàng),該廠商應(yīng)該備有書(shū)面程序和批準(zhǔn)程序以及援引的文件證明。一有可能,應(yīng)該通過(guò)監(jiān)察來(lái)驗(yàn)證廠商對(duì)于書(shū)面程序的遵守。這些范圍不限于原料藥成品,也可能包括起始原料和中間體。這些范圍不僅可能顯示在該系統(tǒng)內(nèi)的缺陷,而且可能顯示在會(huì)確保范圍擴(kuò)展的其它系統(tǒng)內(nèi)的缺陷。除了質(zhì)量系統(tǒng)以外,在為了覆蓋而選擇本系統(tǒng)時(shí),應(yīng)該覆蓋下文列舉的所有區(qū)域;但是,覆蓋的實(shí)際深度可以因計(jì)劃的檢查策略而異,取決于檢查所發(fā)現(xiàn)的情況。
● 員工的培訓(xùn)/資格確認(rèn)。
● 實(shí)驗(yàn)室操作人員的適應(yīng)性。
● 用于預(yù)期用途的設(shè)備和設(shè)施的適應(yīng)性。
● 分析儀器和設(shè)備的校準(zhǔn)和維修程序。
● 計(jì)算機(jī)化過(guò)程或者自動(dòng)化過(guò)程的驗(yàn)證和保障。
● 參比標(biāo)準(zhǔn);來(lái)源、純度和含量分析、以及確定當(dāng)前法定參比標(biāo)準(zhǔn)適宜性的等效性測(cè)試。
● 色譜系統(tǒng)上系統(tǒng)適應(yīng)性檢查。
● 規(guī)格、標(biāo)準(zhǔn)和代表性取樣計(jì)劃。
● 分析方法的驗(yàn)證和確認(rèn)。
● 在正確的樣品上以及用經(jīng)批準(zhǔn)的或者立案的方法或者等效方法進(jìn)行預(yù)期的測(cè)試。
● 任何偏差的文件證明(在質(zhì)量系統(tǒng)下的關(guān)鍵偏差調(diào)研)。
● 來(lái)自于所有的測(cè)試和結(jié)果匯總的完整的分析記錄。
● 原始數(shù)據(jù)(例如色譜圖和光譜)的質(zhì)量和保管。
●結(jié)果匯總與原始數(shù)據(jù)的關(guān)聯(lián);未使用數(shù)據(jù)的存在和處置。
● 遵守非正常規(guī)格(OOS,Out of Specification)的妥善程序(包括及時(shí)完成調(diào)研)。
● 用于確定每個(gè)原料藥工藝的完整雜質(zhì)分布情況的試驗(yàn)方法(注:雜質(zhì)分布情況經(jīng)常與工藝相關(guān))。
● 妥善的留樣;留樣檢查的文件證明。
● 穩(wěn)定性試驗(yàn)程序,包括展示顯示試驗(yàn)方法能力的穩(wěn)定性。
對(duì)于實(shí)驗(yàn)室系統(tǒng)的ICH Q7A參考文獻(xiàn):
● §11,實(shí)驗(yàn)室控制
● §6,文件證明和記錄
● §12,驗(yàn)證
ICH Q7A§3,《員工》和§6,《文件證明和記錄》適用于所有系統(tǒng)。§19,《用于臨床試驗(yàn)的原料藥》適用于預(yù)期應(yīng)用于生產(chǎn)僅僅用于臨床試驗(yàn)的制劑的原料藥。
機(jī)構(gòu)和人員(包括在任何指定系統(tǒng)內(nèi)任職的機(jī)構(gòu)和人員的充分資格和培訓(xùn))將被作為該系統(tǒng)操作的一部分進(jìn)行評(píng)價(jià)。為了運(yùn)用現(xiàn)版GMP(cGMP),需要生產(chǎn)記錄、控制記錄或者分銷記錄;以及為了在上述每個(gè)系統(tǒng)的情況內(nèi)驗(yàn)收審計(jì),應(yīng)該包括選擇來(lái)評(píng)論的那些記錄。合同公司的檢查應(yīng)該在中間體或者原料藥或者服務(wù)作為合同標(biāo)的的系統(tǒng)內(nèi),同時(shí)包括其質(zhì)量系統(tǒng)的評(píng)價(jià)。

DeepSeek火出圈,AI和大模型將如何改變物流行業(yè)?
3223 閱讀
800美元不再免稅,T86清關(guān)作廢,跨境小包何去何從?
2240 閱讀
凈利潤(rùn)最高增長(zhǎng)1210%、連虧7年、暴賺暴跌……物流企業(yè)最賺錢最虧錢的都有誰(shuí)
2202 閱讀浙江科聰完成數(shù)千萬(wàn)元A2輪融資
2102 閱讀AI紅利來(lái)襲!你準(zhǔn)備好成為第一批AI物流企業(yè)了嗎?
2010 閱讀供應(yīng)鏈可視化:從神話到現(xiàn)實(shí)的轉(zhuǎn)變之路
1448 閱讀運(yùn)輸管理究竟管什么?
1294 閱讀Deepseek在倉(cāng)庫(kù)規(guī)劃中的局限性:基于案例研究
1319 閱讀2024中國(guó)儲(chǔ)能電池TOP10出爐
1200 閱讀安能物流2024年經(jīng)調(diào)整利潤(rùn)預(yù)增約62.8%,高質(zhì)量增長(zhǎng)領(lǐng)跑快運(yùn)行業(yè)!
1089 閱讀